Evaluación del riesgo de impurezas mutagénicas a lo largo del proceso de desarrollo y fabricación
Desde principios de la década de 2000 y la aparición de las primeras directrices relativas a las impurezas mutagénicas elaboradas por la Agencia Europea del Medicamento (EMA), ha sido necesario evaluar el riesgo que suponen las impurezas mutagénicas. Aunque al principio se pensó que evitarlas era una opción, pronto se vio que no era una estrategia viable. El estado actual de la metodología química es tal que resulta imposible construir moléculas sintéticas sin utilizar reactivos potencialmente mutagénicos o mutagénicos, que son necesarios para formar enlaces de carbono. Una vez establecido esto, se convierte en una cuestión de evaluación de riesgos y de establecimiento de un control eficaz.
La ICH M7 es única entre las directrices de la ICH en el sentido de que es aplicable durante todo el desarrollo, a diferencia de otras que sólo pueden ser aplicables en el momento de la solicitud de comercialización. En consecuencia, se requiere una evaluación del riesgo de impurezas mutagénicas antes de cualquier evaluación clínica del medicamento en cuestión. ¿Cómo se hace esto? La norma ICH M7 ofrece una muy buena descripción de lo que se requiere. Sin embargo, es importante establecer un enfoque sistemático para realizar con precisión la evaluación del riesgo en la práctica.
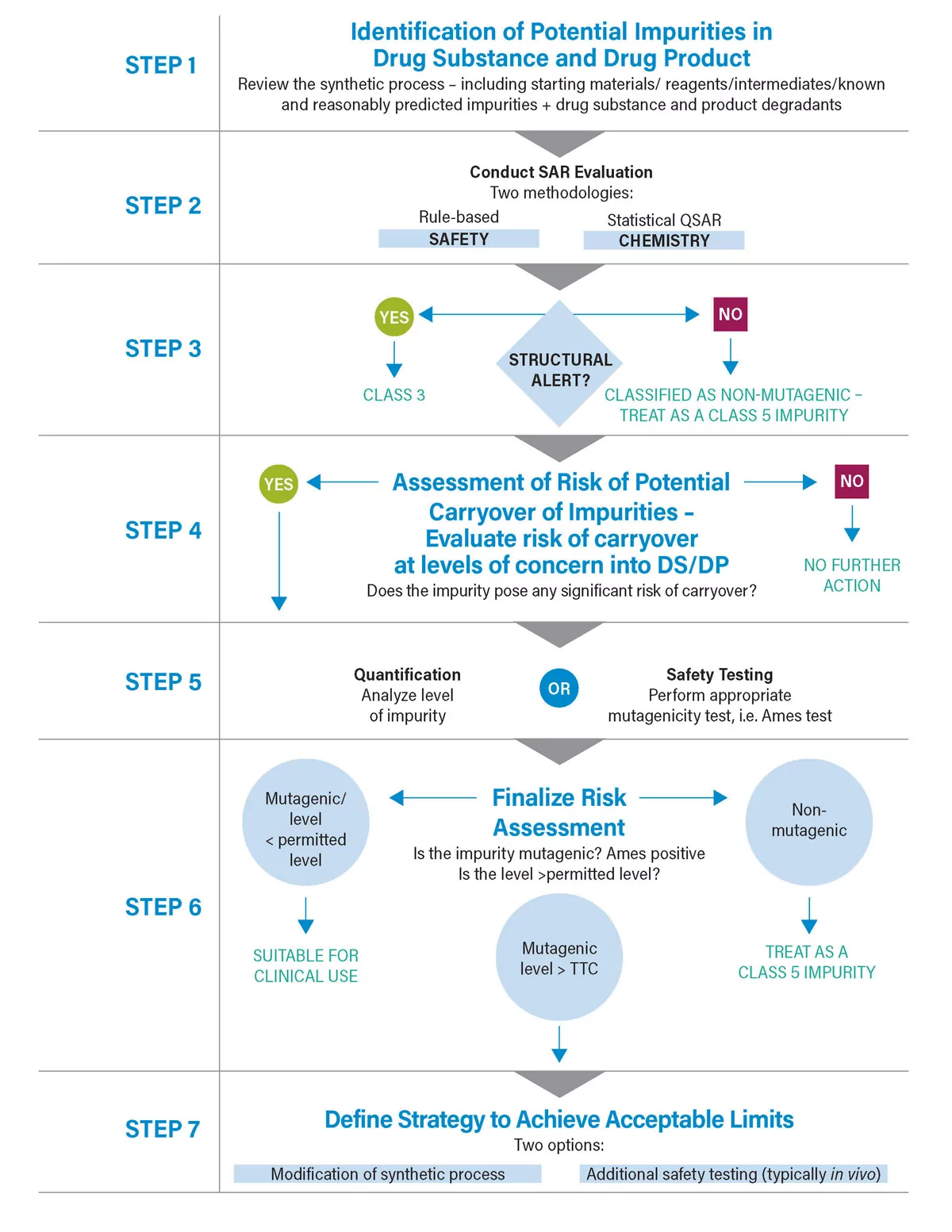
A continuación se presenta un diagrama de flujo del proceso que describe un posible enfoque. Es importante señalar que esto requiere un enfoque multidisciplinar. En muchos sentidos, el proceso puede considerarse como un relevo; una vez que se ha completado un aspecto, se pasa a otra disciplina, es decir, de la química a la seguridad, o de la química al análisis, hasta que se complete la evaluación de riesgos. En su forma más sencilla, la evaluación de riesgos debe responder a dos preguntas:
- ¿Existen impurezas mutagénicas asociadas a la fabricación y almacenamiento del medicamento (tanto del producto activo como del formulado)? En caso afirmativo:
- ¿Están presentes en niveles preocupantes?
Sólo si la respuesta a la pregunta 2 es "sí" hay un problema.

Examine brevemente cada paso. Quizá la más difícil sea la etapa 1: ¿en qué parte del proceso y qué impurezas deben evaluarse? La norma ICH M7 establece que esto debe incluir los materiales de partida, los reactivos, los productos intermedios y las impurezas identificadas y razonablemente previstas. De todas ellas, la más difícil es la última. ¿Cómo se define si una impureza es razonablemente predecible todas las impurezas posibles? Los recientes problemas relacionados con las nitrosaminas ponen esto en evidencia. Se trata de un caso de impureza inesperada, no prevista y potencialmente cancerígena que surgió en la fabricación y acabó en múltiples productos farmacéuticos. Lo que se necesita es una buena comprensión de las posibles reacciones secundarias que pueden generar impurezas mutagénicas. En la actualidad se está intentando garantizar una mejor comprensión en este ámbito vital.
Una vez identificadas las impurezas relevantes, el siguiente paso es evaluar la potencial mutagenicidad de las impurezas en cuestión, es decir, la evaluación SAR (relación estructura-actividad). La norma ICH M7 es bastante prescriptiva, insistiendo en el uso de herramientas in-silico para ello y especificando el uso de dos metodologías diferentes. También subraya la importancia de los conocimientos de los expertos para evaluar los resultados. Este enfoque es posible debido a la fuerte correlación entre la estructura y la mutagenicidad.
La evaluación del SAR filtra efectivamente cerca del 90% de las impurezas, dejando un pequeño número de compuestos mutagénicos o potencialmente mutagénicos. La siguiente etapa consiste en evaluar el riesgo. Para ello, se evalúa la mutagenicidad real de la impureza -normalmente mediante un ensayo bacteriano de mutación inversa- o se evalúa el potencial de arrastre a niveles preocupantes, ya sea mediante cálculos o análisis.
En caso necesario, la norma ICH M7 incluye una serie de opciones de control. La opción 4 permite demostrar el control mediante la evaluación del potencial de arrastre, evaluando las propiedades fisicoquímicas de la impureza y correlacionándolas con las condiciones del proceso(factor de purga). Si esto no ofrece suficientes garantías, puede ser necesario realizar pruebas. Este análisis de trazas puede ser un reto, dados los bajos niveles implicados y la naturaleza a menudo altamente reactiva de la impureza.
Una vez recogidos todos los datos, se puede completar la evaluación de riesgos y responder a la segunda pregunta crítica (¿Existen las impurezas mutagénicas a niveles preocupantes?). La experiencia demuestra que el uso de un enfoque sistemático como el descrito suele demostrar el control de la impureza. Mi próximo blog profundiza en el proceso establecido por las agencias reguladoras mundiales para cuantificar y evaluar la presencia de N-nitrosaminas. Esté atento.
Andy Teasdale, PhD, es científico principal, gestión de impurezas y promoción externa en AstraZeneca
Temas populares
ACQUITY QDa (17) bioanalysis (11) biologics (14) biopharma (26) biopharmaceutical (36) biotherapeutics (17) case study (17) chromatography (14) data integrity (22) food analysis (12) HPLC (15) LC-MS (22) liquid chromatography (LC) (20) mass detection (16) mass spectrometry (MS) (54) method development (13) STEM (12) sustainability (12)