Évaluation du risque d'impuretés mutagènes tout au long du processus de développement et de fabrication
Depuis le début des années 2000 et l'apparition des premières directives relatives aux impuretés mutagènes élaborées par l'Agence européenne des médicaments (EMA), il est nécessaire d'évaluer le risque posé par les impuretés mutagènes. Bien que l'on ait d'abord pensé que l'évitement était une option, il est rapidement apparu que ce n'était pas une stratégie viable. L'état actuel de la méthodologie chimique est tel qu'il est impossible de construire des molécules synthétiques sans utiliser des réactifs qui sont soit potentiellement mutagènes, soit mutagènes ; ceux-ci sont nécessaires pour former des liaisons carbone. Ceci étant établi, il s'agit alors d'évaluer les risques et de mettre en place un contrôle efficace.
L'ICH M7 est unique parmi les directives de l'ICH en ce sens qu'elle est applicable tout au long du développement, contrairement à d'autres qui peuvent n'être applicables qu'au moment de la demande de commercialisation. En conséquence, une évaluation du risque d'impureté mutagène est requise avant toute évaluation clinique du médicament en question. Comment procède-t-on à cette évaluation ? L'ICH M7 donne un très bon aperçu de ce qui est requis. Cependant, il est important d'établir une approche systématique pour mener précisément l'évaluation des risques dans la pratique.
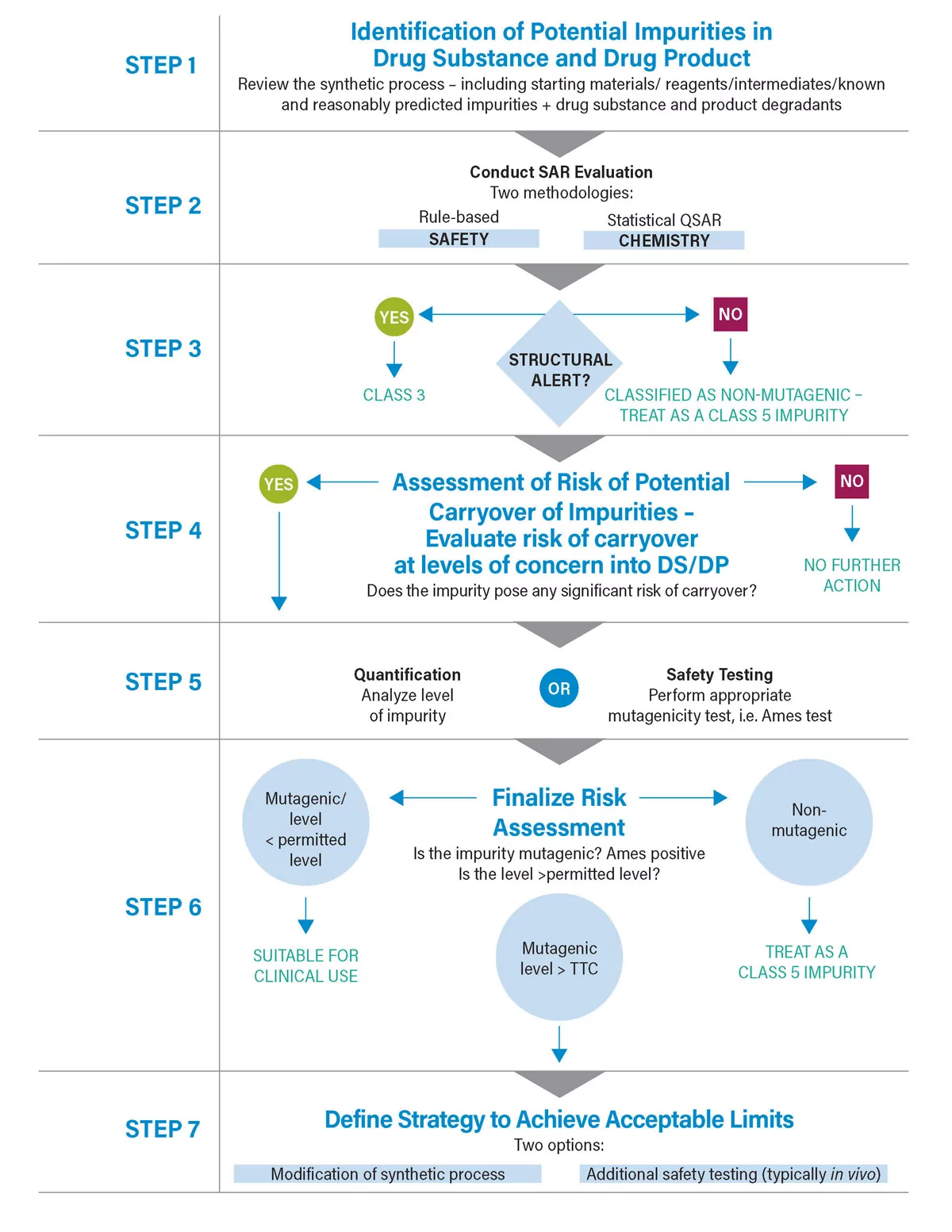
Vous trouverez ci-dessous un diagramme de processus décrivant une approche potentielle. Il est important de noter que cela nécessite une approche multidisciplinaire. À bien des égards, le processus peut être considéré comme un relais ; une fois qu'un aspect est terminé, il passe à une autre discipline, par exemple de la chimie à la sécurité, ou de la chimie à l'analyse, jusqu'à ce que l'évaluation des risques soit terminée. Dans son expression la plus simple, l'évaluation des risques doit répondre à deux questions :
- Y a-t-il des impuretés mutagènes associées à la fabrication et au stockage du médicament (produit actif et formulé) ? Si oui, alors :
- Sont-ils présents à des niveaux préoccupants ?
Ce n'est que si la réponse à la question 2 est "oui" qu'il y a un problème.

Examinez brièvement chaque étape. L'étape la plus difficile est peut-être l'étape 1 : où dans le processus et quelles impuretés doivent être évaluées ? L'ICH M7 indique que cela doit inclure les matières premières, les réactifs, les produits intermédiaires, les impuretés identifiées et raisonnablement prévues. Parmi ces éléments, le plus difficile est le dernier. Comment définir si une impureté est une prédiction raisonnable de toutes les impuretés possibles ? Les problèmes récents liés aux N Nitrosamines mettent cette question en évidence. Il s'agit d'une impureté inattendue, non prévue et potentiellement cancérigène, qui est apparue au cours de la fabrication et s'est retrouvée dans plusieurs produits pharmaceutiques. Ce qu'il faut, c'est une bonne compréhension des réactions secondaires potentielles qui peuvent générer des impuretés mutagènes. Des tentatives sont actuellement en cours pour assurer une meilleure compréhension dans ce domaine vital.
Une fois que les impuretés pertinentes ont été identifiées, l'étape suivante consiste à évaluer la mutagénicité potentielle des impuretés concernées, c'est-à-dire l'évaluation SAR (Structure Activity Relationship). L'ICH M7 est assez prescriptive, insistant sur l'utilisation d'outils in-silico pour ce faire et spécifiant l'utilisation de deux méthodologies différentes. Elle souligne également l'importance des connaissances d'experts pour évaluer les résultats. Une telle approche est possible en raison de la forte corrélation entre la structure et la mutagénicité.
L'évaluation du SAR permet de filtrer efficacement près de 90 % des impuretés, laissant un petit nombre de composés mutagènes ou potentiellement mutagènes. L'étape suivante consiste à évaluer plus précisément le risque. Pour ce faire, nous évaluons la mutagénicité réelle de l'impureté - généralement par le biais d'un test bactérien de mutation inverse - ou en évaluant le potentiel de transfert à des niveaux préoccupants, par le biais de calculs ou d'analyses.
Si nécessaire, l'ICH M7 comprend un certain nombre d'options de contrôle. L'option 4 permet de démontrer le contrôle en évaluant le potentiel de transfert en évaluant les propriétés physico-chimiques de l'impureté et en les corrélant aux conditions du procédé(facteur de purge). Si cela ne donne pas une assurance suffisante, des essais peuvent être nécessaires. Une telle analyse de traces peut être difficile, étant donné les faibles niveaux impliqués et la nature souvent très réactive de l'impureté.
Une fois que toutes les données ont été collectées, l'évaluation des risques peut être achevée et la deuxième question critique peut être résolue (les impuretés mutagènes existent-elles à des niveaux préoccupants ?) L'expérience montre que l'utilisation d'une approche systématique telle que celle décrite démontre généralement le contrôle de l'impureté. Dans mon prochain blog, j'approfondirai le processus établi par les organismes de réglementation mondiaux pour quantifier et évaluer la présence de N-nitrosamines. Restez à l'écoute !
Andy Teasdale, PhD, est un scientifique principal senior, chargé de la gestion des impuretés et du plaidoyer externe chez AstraZeneca.
Sujets populaires
ACQUITY QDa (17) bioanalysis (11) biologics (14) biopharma (26) biopharmaceutical (36) biotherapeutics (17) case study (17) chromatography (14) data integrity (22) food analysis (12) HPLC (15) LC-MS (22) liquid chromatography (LC) (20) mass detection (16) mass spectrometry (MS) (54) method development (13) STEM (12) sustainability (12)