柱子也很重要。为纳米流和微流LC-MS选择最佳条件
第三部分:优化诱捕条件
本系列的上一篇文章讨论了固定相在蛋白质组多肽分析中的细节、作用和优势,以及捕集器和分析柱的保留率如何改善你的多肽分离。在这里,我想简单地谈谈捕集条件,如流速和捕集量,因为根据我的经验,这是一个经常被忽视的参数。
- 第一部分:如何通过考虑分离本身来改善纳米和微流LC-MS蛋白质组学的研究
- 第二部分:为NanoFlow和Microflow LC-MS选择最佳固定相
- 第三部分:优化诱捕条件
诱捕的基本原理
捕获柱往往有更大的内径,与分析柱相比,其填料的颗粒更大。这允许在更高的流速下装载更大体积的样品,正如在之前的文章中所讨论的。有效的捕集可以在较大的样品中捕获所有感兴趣的分析物,同时丢弃干扰性化合物。这需要在捕集步骤中仍然保留最亲水的化合物,并且能够以小体积洗脱所有分析物,以成功地在分析柱上重新聚焦条带。
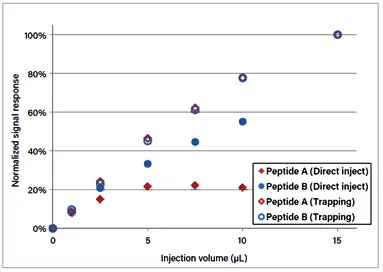
一般来说,使用捕集技术可以增加分析的动态范围,允许注入更多的样品并减少样品基质的负面影响。
优化诱捕条件时的考虑因素
在捕集步骤中,亲水肽的损失并不罕见,因为肽的回收主要取决于保留。可以通过相应地调整捕集条件来优化肽的回收。
由于捕集柱的保留率最好低于分析柱的保留率,因此是固定的,应该调整的参数之一是捕集过程中的溶剂强度。强度较低的溶剂将有助于在捕集柱上更好地捕获保留率较低的物种。
另外,装载量需要足够大,以便将样品从注射环路运送到捕集器上,并洗掉不需要的化合物,如盐和其他离子干扰物。但是捕集体积需要足够小,以避免洗掉那些弱保留的肽。这也需要考虑注入样品的溶剂成分,以及在加载过程中它会如何影响最终的溶剂成分。此外,在捕集过程中的流速也需要优化。
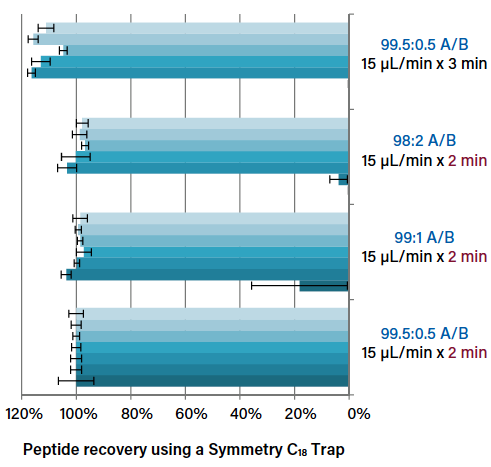
图2显示了在使用一种溶剂浓度时,流速和捕集时间以及由此产生的整体捕集体积是如何影响多肽回收的。当样品被捕集的体积过大时,亲水肽损失的机会急剧增加。
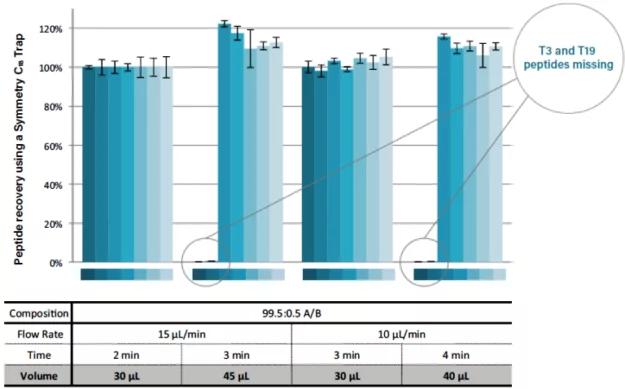
改变溶剂成分也会对多肽的回收产生影响,较强的溶剂更容易洗掉保留率较低的多肽。

在开发用于纳米或微流LC-MS分析的捕集-洗脱方法时,优化捕集方法不应该是一个被忽视的步骤。了解捕集柱以及分析柱的固定相的整体保留率和选择性是有益的。一个调整好的捕集-洗脱方法将增加你的方法的动态范围,因为它允许你注入更多的样品,而且由于基质效应的减少,它也将增加分析的整体灵敏度。
额外的资源。
- 什么是微流水?
- 由于减少了矩阵效应,Microflow LC提供了更好的灵敏度
- Nano and Micro LC columns 来自Waters
- 白皮书。 Considerations for Selecting Optimal Stationary Phases for Proteomic Trap-and-Elute Nanochromatography
- 想要更深入的了解吗?请回放我们最近由SelectScience主办的网络研讨会,选择最佳固定相的考虑,用于蛋白质组捕集和洗脱的纳米LC-MS,由Waters的Moon Chul Jung博士主讲。
热门话题
ACQUITY QDa (17) bioanalysis (11) biologics (14) biopharma (26) biopharmaceutical (36) biotherapeutics (17) case study (17) chromatography (14) data integrity (22) food analysis (12) HPLC (15) LC-MS (22) liquid chromatography (LC) (20) mass detection (16) mass spectrometry (MS) (54) method development (13) STEM (12) sustainability (12)


