数据完整性问题|不合理的 "孤儿 "数据的无效性

孤儿数据。删除或不删除
2017年2月,美国FDA就一个单一的主题发出了一封简短的警告信。孤儿数据的无理失效(和删除)。
"我们的调查员审查了你用来进行高效液相色谱(HPLC)和气相色谱(GC)分析的各种独立的实验室设备的审计跟踪。我们的调查员发现,你从你的独立电脑中删除了整个色谱序列和个别注射。在没有提供科学依据的情况下,你重复分析直到获得可接受的结果。你没有调查原始的超规格或其他不理想的测试结果,你只在日志和准备笔记本中记录了合格的测试结果。你依靠这些被操纵的测试结果和不完整的记录来支持批次释放的决定。"
我们是否问对了问题?

色谱分析可能不是一门精确的科学,但它在很大程度上依赖于原始方法的稳健性(包括其定期审查和更新)和大量单个组件的一致性能。样品、标准品和溶剂制备步骤、泵、注射器、检测器和数据采集硬件、实验室温度、色谱柱的稳定性和性能、用户技能和培训、过程中的自动化程度、数据输入或计算出的最终结果中出现人工错误的机会、SOP的清晰度、测试准备的可追溯性(或监管链)、审查人员的技能 - 和知识。
在这些贡献属性中的任何一个方面的失败或失误,都可能很容易导致一系列的结果需要失效和重复。必须提出的关键问题是:
"如果分析员或实验室工作人员试图使'不理想'的结果无效,审查过程是否会将这种恶劣的行为与预期的正常纠错行为区分开来?"
最简单和最重要的步骤是永远不要删除无主数据
然后,任何审查员或QA专业人员都有机会审查无效的数据,并判断其无效性是否有科学依据。但同样的,关键是不要试图从对早期创建的数据和相关的审计跟踪进行0%的审查,转而期望对所有的数据和所有的元数据包括所有的审计跟踪进行100%的审查。除了在接受一个结果为真实之前审查每个分析员的每一个行动的生产力问题之外,审查员在他们所审查的主题方面的技能和知识可能需要被大幅评估和加强。
但我们如何管理审查后的孤儿数据结果?所有的数据应该永远跟随结果吗?
为此,我看一下世界卫生组织(WHO)是如何定义总结报告的。
"一旦完成对所有电子数据的详细审查,并创建和审查一份准确反映所有数据的总结报告,那么该总结可用于进一步决策。"
如果一些专家评审员评估了摘要或最终数据集或 "报告",并确信任何孤儿数据或创建的结果都可以在科学上无效并被忽略,数据与电子记录中的数据相匹配,而且摘要中报告的 "最终 "数值是值得信任的--从这一点上看,摘要中的信息可以被视为 "官方",可以在任何进一步的报告要求或决策中利用,即在研究报告或分析证书中。
与计算机系统验证(CSV)实践的演变类似,行业和监管机构需要时间来商定如何成功地应用基于风险的方法来 "审查完整数据"。这一挑战的关键是界定哪些数据需要被审查,以何种格式,多长时间审查一次,以及如何记录审查过程(在关键桩监测或对整个分析分析过程进行录像之外)。
这适用于所有类型的测试和数据记录,但由于依赖分析员的知识和技能来正确解释色谱数据,这就成为定义强大的审查程序与实施不可能控制的关键领域。
信息图。满足实验室计算机化系统合规的技术要求
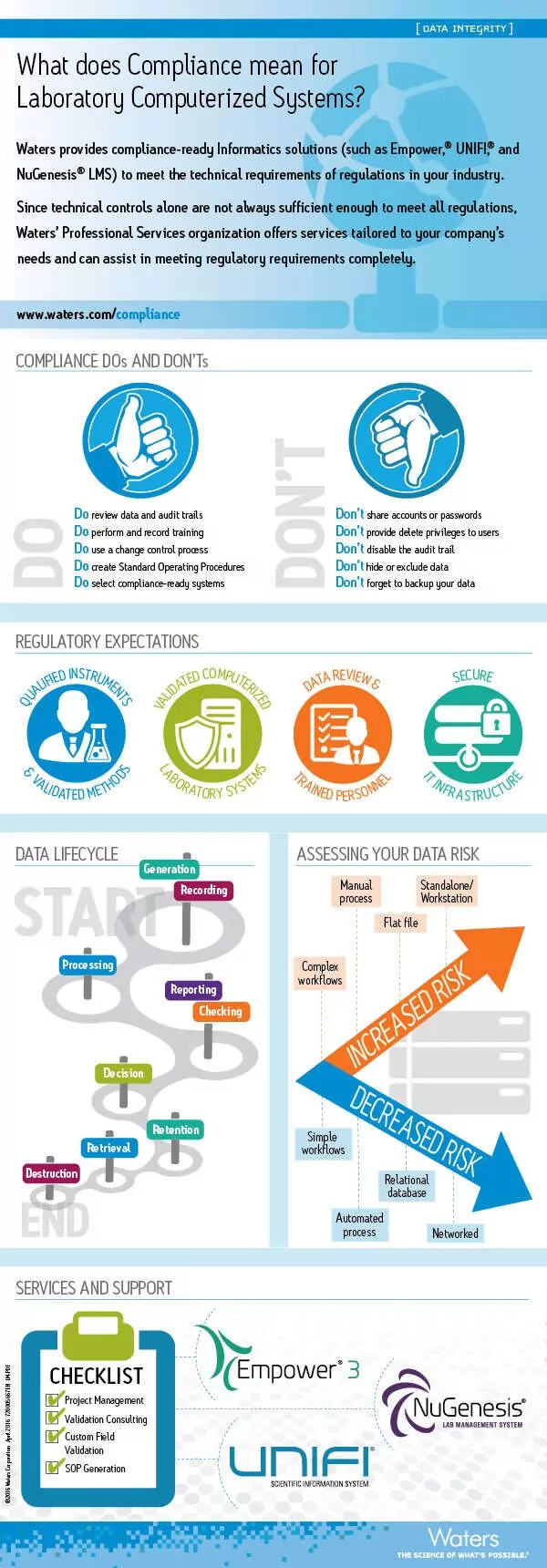
阅读Heather Longden的博客系列中的更多文章,数据完整性的重要性。
更多资源。
- On-demand webinar: 为什么电子CDS数据是监管机构的主要数据完整性问题?
- 合规对实验室计算机化系统意味着什么? Read our white paper
- 了解更多关于 ensuring Quality through compliance 与Waters
热门话题
ACQUITY QDa (17) bioanalysis (11) biologics (14) biopharma (26) biopharmaceutical (36) biotherapeutics (17) case study (17) chromatography (14) data integrity (22) food analysis (12) HPLC (15) LC-MS (22) liquid chromatography (LC) (20) mass detection (16) mass spectrometry (MS) (54) method development (13) STEM (12) sustainability (12)


