丢失在容器中的样品。非特异性结合和阻断剂的影响

我的样品留在了溶液中......或者是吗?
 样品是宝贵的。准备好的样品是所有成功实验的起点。这就是为什么我们花时间和精力在样品制备上;这样得到的样品就可以用于下游的液相色谱分析。当我们想到良好的样品准备和处理时,我们强调样品的纯度、浓度、体积等,但往往忽略了样品在储存过程中恢复的重要性。事实上,一个准备得很好的样品在等待进样时丢失在样品容器的表面是很常见的。
样品是宝贵的。准备好的样品是所有成功实验的起点。这就是为什么我们花时间和精力在样品制备上;这样得到的样品就可以用于下游的液相色谱分析。当我们想到良好的样品准备和处理时,我们强调样品的纯度、浓度、体积等,但往往忽略了样品在储存过程中恢复的重要性。事实上,一个准备得很好的样品在等待进样时丢失在样品容器的表面是很常见的。
我的珍贵样品怎么了?
这种与表面的意外结合被称为非特异性结合(NSB)或非特异性吸附(NSA)。这些术语最初来自配体结合试验,在这种试验中,预计只有通过分析物和其受体之间的特定相互作用才能捕获分析物。所有其他的结合被称为非特异性。如今,NSB和NSA这两个术语被用来描述任何未被计划的结合相互作用以及随之而来的分析物损失。
 虽然NSB可以发生在任何分子上,但它最经常被观察到的是生物大分子,如蛋白质和肽。这是因为这些生物大分子可以形成几个化学上不同的区域。这些区域可能通过各种吸引机制与暴露的表面相互作用,如亲水、疏水、离子等。这种众多的化学相互作用促进了NSB,同时也有效地阻止了它们的完全解吸(从表面脱离)。更糟的是,一些复杂的生物大分子,如折叠的蛋白质,在与表面结合后会发生构象变化,以进一步加强粘附力。因此,这种变形的蛋白质很难从表面上分离,而且你可能永远也拿不回来了!"。
虽然NSB可以发生在任何分子上,但它最经常被观察到的是生物大分子,如蛋白质和肽。这是因为这些生物大分子可以形成几个化学上不同的区域。这些区域可能通过各种吸引机制与暴露的表面相互作用,如亲水、疏水、离子等。这种众多的化学相互作用促进了NSB,同时也有效地阻止了它们的完全解吸(从表面脱离)。更糟的是,一些复杂的生物大分子,如折叠的蛋白质,在与表面结合后会发生构象变化,以进一步加强粘附力。因此,这种变形的蛋白质很难从表面上分离,而且你可能永远也拿不回来了!"。
NSB可以毁掉一个精心策划的实验。它可能导致不准确的定量结果,甚至更糟糕的是,你可能根本得不到任何信号!"。
如何避免这个棘手的问题,是否有效?
这个NSB问题根本就不是一个新问题。对于长期与蛋白质和肽打交道的生物科学家来说,它是广为人知的。为了避免这个问题,科学家们根据这两个原则想出了许多变通办法。
- 原则1 - 改变化学环境以消除或减少不需要的相互作用。
- 改变溶液的pH值以减少离子相互作用
- 添加盐类以改变离子强度
- 向溶液中加入有机溶剂
因为每一种分析物都有其独特的化学特性,所以没有一种条件可以适用于所有的样品。此外,改变pH值或添加有机溶剂可能会改变生物大分子的特性,如其电荷状态或折叠结构。在样品中添加盐可能会促进质谱检测中的离子抑制。
- 原则2--添加阻断剂以掩盖表面上潜在的NSB位点。
- 添加聚合物,如PEG
- 添加洗涤剂,如Tween-20或Triton X-100
- 加入载体蛋白,如牛血清白蛋白(BSA)或酪蛋白
添加阻断剂基本上是将杂质重新添加到已净化的样品中。洗涤剂和大型聚合物对LC-MS分析特别不利,因为它们可能改变柱子的选择性并增加背景。众所周知,它们会影响质谱的电离,引起严重的离子抑制。此外,从柱子和其他系统部件中去除它们是非常困难的。
虽然它相当有效,但使用阻断剂可能不是制备LC-MS样品的最佳选择。
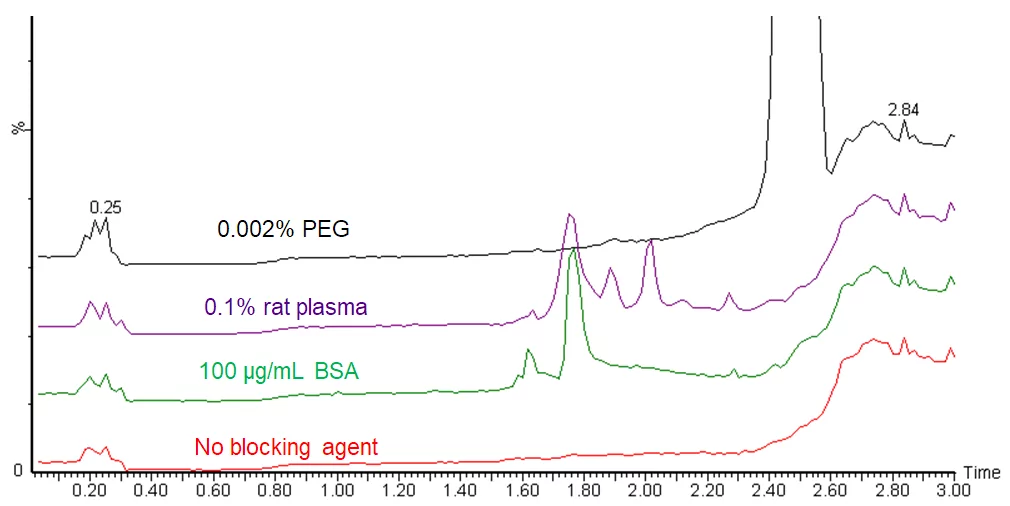
与使用洗涤剂和聚合物相比,添加载体蛋白是一个问题较少的选择。这是一个对LC-MS样品更有利的解决方案,但仍然不是完美的解决方案。蛋白质会在色谱图中显示为杂质峰,见图。
人们可以通过使用单一质量监测或SRM方法来避免看到杂质峰,只监测目标分析物,但这些杂质仍然可以通过离子抑制或增强在背后影响你的分析。在全扫描分析中,它们在质谱中显示为额外的峰,使解释变得复杂。此外,处理含有高浓度蛋白质的溶液更加困难。溶液中的蛋白质既有亲水区又有疏水区,其行为如同表面活性剂。蛋白质溶液很容易形成泡沫或气泡,移液过程中的起泡可能导致测量错误。
在某些情况下,阻断剂是必要的,但如果你能在没有阻断剂的情况下制作样品,则要理想得多。
到目前为止,我们考虑了非特异性结合(NSB)的问题以及避免NSB的常见方法的利弊。 在下一篇博文中,我们将看到这些限制如何影响你的样品制备工作流程。
请关注我们的下一篇博文 "多肽和蛋白质的LC-MS定量分析前的样品准备",作者Kim Haynes。
额外的资源。
热门话题
ACQUITY QDa (17) bioanalysis (11) biologics (14) biopharma (26) biopharmaceutical (36) biotherapeutics (17) case study (17) chromatography (14) data integrity (22) food analysis (12) HPLC (15) LC-MS (22) liquid chromatography (LC) (20) mass detection (16) mass spectrometry (MS) (54) method development (13) STEM (12) sustainability (12)